一直以来���,因疗效、清静性等问题屡被诟病���,中药注射剂恒久处于风口浪尖���。据米内网MED中国药品审评数据库2.0数据统计���,最近五年���,获批生产的中药注射剂新品险些没有���,而获批临床的也是少之又少���,2017年仅有银杏内酯B注射液���,2016年仅有注射用丹酚酸A���,2015年一个都没有……
2018年1月30日���,昆药集团宣布通告称���,该公司的中药注射剂“注射用KPCXM18”获CFDA批准临床���,该产品拟用于急性缺血性脑��;颊���。据悉���,注射用KPCXM18是按自然药物1类新药申报���,现在尚无企业获得该药品的生产批文���。
中药注射剂突破中药古板的给药方法���,是中药现代化的主要产品���。一经景物的中药注射剂���,为何现在却深陷争议漩涡?以中药注射剂为主营营业的药企未来又将怎样?
中药注射剂总规模凌驾千亿
心脑血管疾病用药占67%
图1:中国公立医疗机构终端中成药注射剂年度销售趋势(单位:万元)
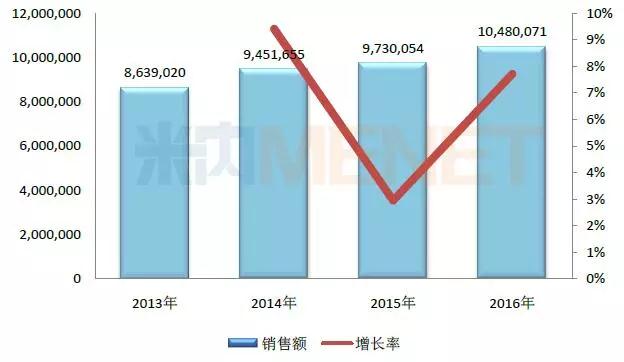
(数据泉源:米内网中国公立医疗机构终端竞争名堂)
据米内网数据显示���,2016年中国都会公立医院、县级公立医院、都会社区中心及州里卫生院(简称中国公立医疗机构)终端中药注射剂的总规模凌驾1048亿元���,其中在中国都会公立医院以及县级公立医院的市场份额合计凌驾八成���。
图2:2016年中国公立医疗机构终端中成药13个大类的注射剂销售额占比情形
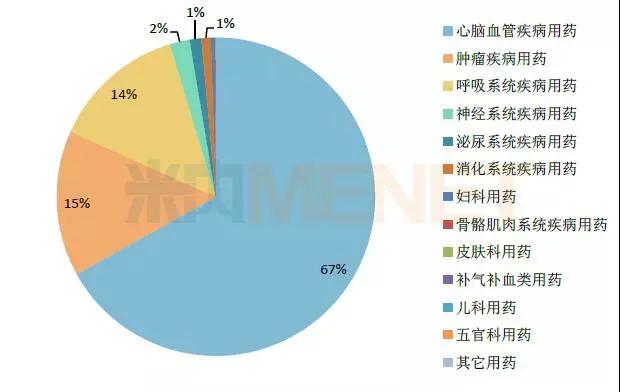
(数据泉源:米内网中国公立医疗机构终端竞争名堂)
在中成药市场的13个大类中���,涉及注射剂的有9个���,其中���,心脑血管疾病用药的占比凌驾六成���,销售额凌驾701亿元���,肿瘤疾病用药以及呼吸系统疾病用药两个大类紧跟厥后���,销售额均凌驾100亿元���。
中药注射剂TOP10产品
7个年销40亿
表1:2016年中国公立医疗机构终端中药注射剂产品TOP10(单位:万元)
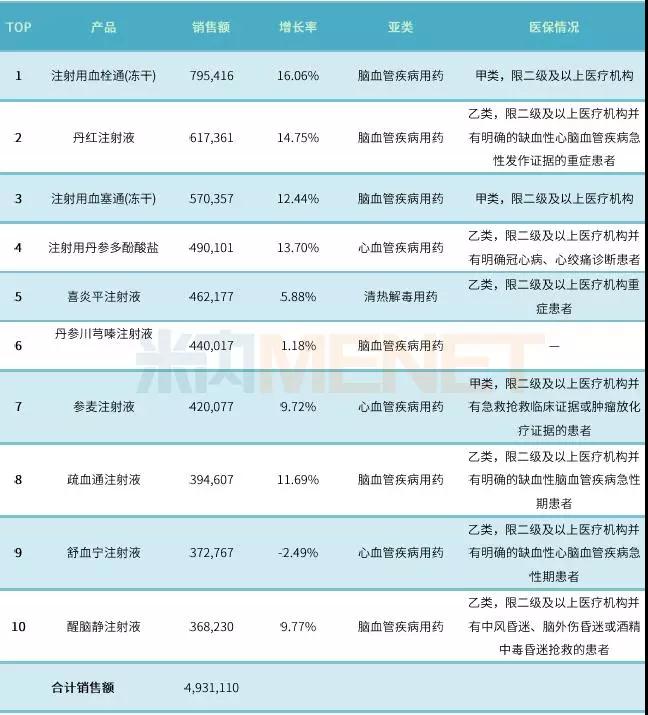
(数据泉源:米内网中国公立医疗机构终端竞争名堂、中国医保目录大全数据库)
数据显示���,2016年中国公立医疗机构终端中药注射剂TOP10产品中有9个属于心脑血管疾病用药���,细分亚类为6个脑血管疾病用药以及3个心血管疾病用药;喜炎平注射液属于呼吸系统疾病用药中的清热解毒用药���。
TOP10产品合计销售额凌驾493亿元���,销售额凌驾40亿元的产品有7个���,除了丹参川芎嗪注射液外���,其余9个均进入了新版国家医保目录���。
图3:2013-2016年注射用血栓通(冻干)在中国公立医疗机构终端的销售情形(单位:万元)
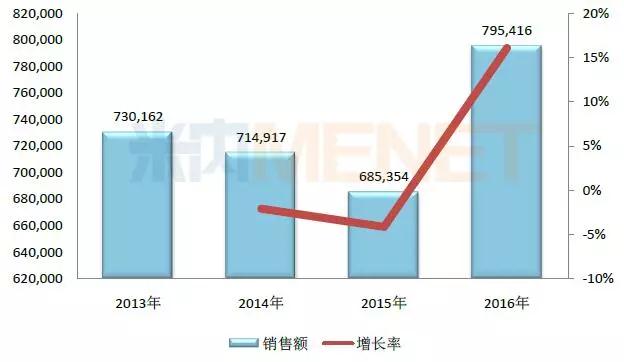
(数据泉源:米内网中国公立医疗机构终端竞争名堂)
注射用血栓通(冻干)是梧州制药(集团)的独家产品���,用于瘀血阻络���,中风偏瘫���,胸痹心痛及视网膜中央静脉壅闭症���,最近几年在中国公立医疗机构终端的销售额在70亿元左右���。
中恒集团2016年年报中提到���,新版国家医保目录中对大部分中药注射剂都加以限制使用���,与其他不但受医疗机构限制同时受病种限制的中药注射剂相比���,注射用血栓通(冻干)仅受部分医疗机构的限制���。本次新版国家医保目录的实验���,短期内不会对公司的谋划业绩造成重大影响���,现在公司正在起劲研究销售战略���。
中恒集整体现���,注射用血栓通正在开展上市后再评价事情���,以天津中医药大学为首的研究团队开展物质基础、药理药效、工艺质量控制、临床疗效视察、多中心不良反应监测等项目的研究���,为产品提供越发深入、周全的临床应用依据���。
图4:2013-2016年丹红注射液在中国公立医疗机构终端的销售情形(单位:万元)
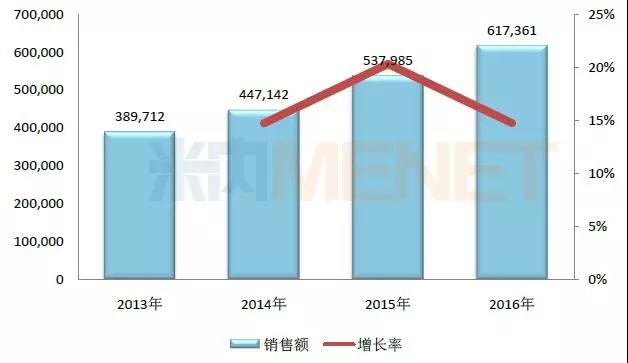
(数据泉源:米内网中国公立医疗机构终端竞争名堂)
丹红注射液是山东丹红制药的独家产品���,用于瘀血闭阻所致的胸痹及中风���,冠心病、心绞痛、心肌梗塞���,瘀血型肺心病���,缺血性脑病、脑血栓等的治疗���。最近几年���,丹红注射液在中国公立医疗机构终端的销售额逐年攀升���,2016年突破了60亿元关口���。
步长制药在2017年半年报中提到���,现在丹红注射液的循证医学研究正在稳步举行���,以挖掘产品潜力、延伸产品生命周期���。
图5:2013-2016年注射用血塞通(冻干)在中国公立医疗机构终端的销售情形(单位:万元)
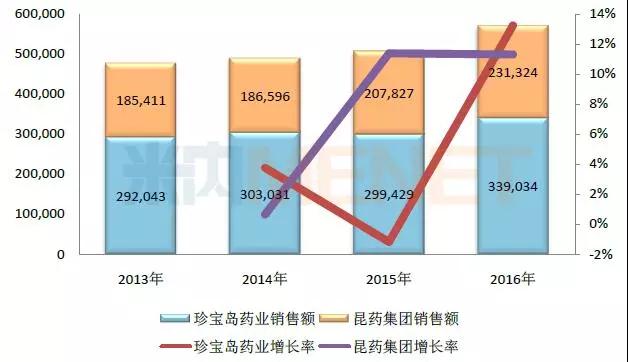
(数据泉源:米内网中国公立医疗机构终端竞争名堂)
注射用血塞通(冻干)用于中风偏瘫、瘀血阻络及脑血管疾病后遗症、视网膜中央静脉壅闭属瘀血阻滞证者的治疗���,该产品获批生产的企业包括了至宝岛药业和昆药集团���。
在市场份额上���,至宝岛药业占六成左右���,该产品最近几年的销售额在30亿元左右���,现在至宝岛药业获批的注射用血塞通(冻干)有三个规格���,包括了100mg、200mg和400mg���。
昆药集团的注射用血塞通(冻干)最近几年的销售额有快速增添的态势���,2016年上涨至23.1亿元���。现在昆药集团获批的注射用血塞通(冻干)有两个规格���,包括了0.2g和0.4g���。
政策一直升级
2018年启动注射剂再评价
近年来���,政府层面临于中药注射剂的关注逐渐加深���。2009年宣布的《关于做好中药注射剂清静性再评价事情的通知》中提到���,将分期分批对中药注射剂的重点品种举行危害效益评价���,第一批开展危害效益评价的品种为双黄连注射剂和参麦注射剂���,第二批再评价品种包括鱼腥草注射液和鱼金注射液���。随后���,审评审批部分对申请上市或临床的中药注射剂把关越发严酷���,最近几年在市场上确实难觅新品���。
2017年2月���,新版国家医保目录正式宣布���,目录中包括的49其中药注射剂中有39个受到差别水平的限制���。在受限品种里���,有26个限二级以上医疗机构使用���,也就意味着这些受限品种失去了大部分的下层市场���。
随后���,CFDA宣布“要启动中药注射剂药品清静性、有用性的再评价事情”���,正式转达了中药注射剂再评价将成为下一阶段的攻艰使命���,并将此作为推进整体药品质量疗效事情重点之一的信号���。
2017年7月1日���,《中华人民共和国中医药法》正式实验���,提出建设切合中医药特点的治理制度���,加大对中医药事业的帮助力度���,坚持帮助与规范并重���,增强对中医药的羁系���,同时加大对中医药违法行为的处分力度���,中药注射剂的评价事情再次迎来要害环节���。
2017年10月���,《关于深化审评审批制度刷新勉励药品医疗器械立异的意见》宣布���,提出将严酷药品注射剂审评审批���,中药注射剂的评价事情将大刀阔斧举行���。CFDA局长毕井泉曾指出���,注射剂的再评价是仿制药质量疗效评价的主要组成部分���,用5—10年完成注射剂的评价事情���,是中办国办印发的《意见》中提出的使命���。注射剂特殊是静脉注射剂���,属于高危害剂型���,必需严酷羁系���。《意见》对注射剂的审评审批做了严酷的限制;对已往已批准上市的注射剂���,要求批准文件持有人举行因素、机理、临床疗效的研究���,评价其清静性、有用性和质量可控性���。总局将尽快明确注射剂再评价的方法要领和时间办法���。
2017年12月���,仿制药质量与疗效一致性评价办公室宣布的关于果真征求《已上市化学仿制药(注射剂)一致性评价手艺要求》意见的通知���,意味着落实“两办36条”中关于“开展药品注射剂再评价”启动的第一步���。
2018年1月���,在北京召开的天下食物药品监视治理暨党风廉政建设事情聚会上���,强调2018年食物药品羁系事情重点要做好八个方面的事情���,其中包括了启动注射剂再评价事情���,推进仿制药质量和疗效一致性评价���,建设企业直接报告不良反应制度等���。
政策一直升级���,且步步紧迫���,审批愈趋严酷���,市场难觅新品���。一些在市场上履历了多年打拼���,成为“一方霸主”的大品种中药注射剂���,已经有了重大的患者群体与口碑支持���,若能顺遂通过“再评价”这一关���,把有用性和清静性堂堂正正地展现出来���,这个千亿市场在汰弱留强后���,一定会给予这些强者更大的回报���。而作为中药现代化的主要产品���,中药注射剂想要走出国门冲向天下���,也将更有说服力���。
资料泉源:米内网数据库、上市公司通告、医药经济报


